Komplet TIANScriptⅡ RT
Lastnosti
■ Visoka encimska aktivnost in učinkovitost: Visoka aktivnost reverzne transkriptaze in dobra združljivost v naslednjih poskusih.
■ Širok razpon substratov: primeren za vse RNA, zlasti za predloge RNA s kompleksnimi sekundarnimi strukturami.
■ Dolga RT dolžina: Sinteza prve verige cDNA lahko doseže 12 kb.
■ Enostavno delovanje: preprosto dodajte potrebne komponente v enem koraku, ne da bi med delovanjem dodali reagent.
Aplikacije
■ Sinteza prve verige cDNA.
■ Izdelava knjižnice cDNA.
■ Enostopenjski RT-PCR.
■ Analiza RACE.
Vse izdelke je mogoče prilagoditi za ODM/OEM. Za podrobnosti,kliknite prilagojeno storitev (ODM/OEM)
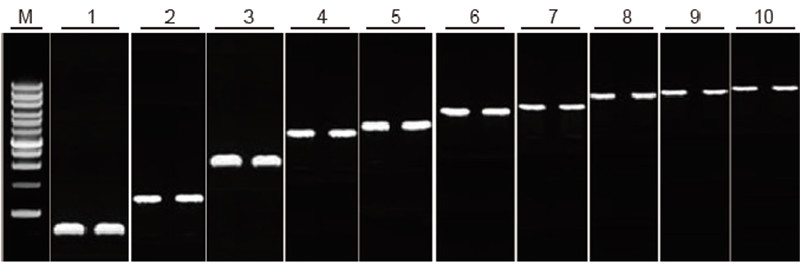 |
Sposobnost povratne transkripcije kompleta TIANScript II RT za fragmente različnih dolžin Metoda: Obratna transkripcija: Glejte priročnik z navodili za komplet TIANScript II RT. Rezultati: Slika gela prikazuje rezultate amplifikacije 10 ciljnih genov z različnimi dolžinami po povratni transkripciji 1 μg celotne RNA. Na stezo smo naložili 2 μl produktov reverzne transkripcije. Ojačevalni sistem (PCR): 20 μl; Obremenitev vzorca: 5 μl; Marker: D15000+1 kb DNA lestev; Koncentracija gela: 1%; Pogoji elektroforeze: 6 V/cm, 20 min Diagram vsakega pasu: M: DNA marker; 1: Dolžina izdelka: 120 bp; 2: Dolžina izdelka: 1 kb; 3: Dolžina izdelka: 2,5 kb; 4: Dolžina izdelka: 3,2 kb; 5: Izdelek dolžina: 4,6 kb; 6: Dolžina izdelka: 6,8 kb; 7: Dolžina izdelka: 7,6 kb; 8: Dolžina izdelka: 8,9 kb; 9: Dolžina izdelka: 10 kb; 10: Dolžina izdelka: 12 kb; |
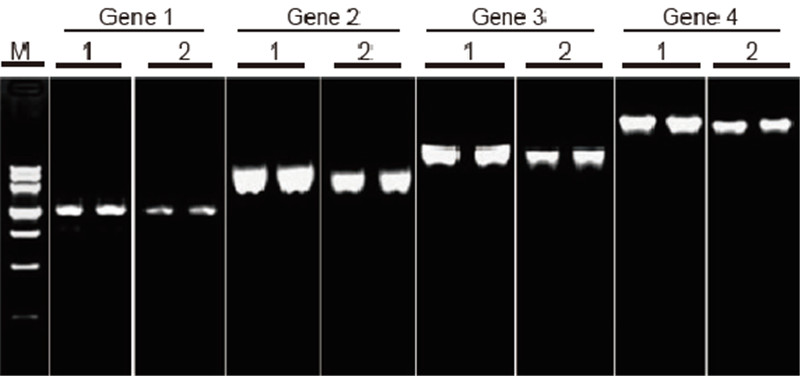 |
Primerjava učinkovitosti in posebnosti kompleta TIANScript II RT in izdelkov drugih dobaviteljev pri obratni transkripciji dolgih predlog Materiali: Skupna RNA človeških adherentnih celic. Začetna količina RT-PCR: 2 μl produkta za povratno transkripcijo (50 ng/μl) Metoda: Obratna transkripcija: Glejte priročnik za uporabo kompleta TIANScript II RT. Rezultati: Slika gela prikazuje rezultate amplifikacije 6 ciljnih genov z različnimi dolžinami po povratni transkripciji 1 μg skupne RNA človeških adherentnih celic z uporabo M-MLV iz dobavitelja A in kompleta TIANGEN TIANScript II RT. Ojačevalni sistem (PCR): 20 μl; Obremenitev vzorca: 5 μl; Marker: DNA MarkerIII; Koncentracija gela: 1%; Pogoji elektroforeze: 6 V/cm, 20 min. Diagram vsakega pasu: M: DNA marker; 1: Rezultati ojačanja reverzne cDNA, prepisane s kompletom TIANScriptII RT; 2. Rezultati ojačanja reverzne cDNA, prepisane z ustreznim izdelkom dobavitelja A. Dolžina produkta gena 1 je 1,3 kb; Dolžina produkta gena 2 je 3,0 kb; Dolžina produkta gena 3 je 5,0 kb; Dolžina izdelka 4 gena je 7,5 kb. |
A-1 RNA se razgradi
—— Očistite visoko kakovostno RNA brez kontaminacije. Material, iz katerega se ekstrahira RNA, mora biti čim bolj svež, da se prepreči razgradnja RNA. Pred reakcijo RT analizirajte celovitost RNA na denaturiranem gelu. Po ekstrakciji RNA jo je treba shraniti v 100% formamidu. Če se uporablja zaviralec RNaze, mora biti temperatura segrevanja <45 ° C, pH pa manjši od 8,0, sicer bo inhibitor sprostil vso vezano RNazo. Poleg tega je treba v raztopine, ki vsebujejo ≥ 0,8 mM DTT, dodati zaviralec RNaze.
A-2 RNA vsebuje zaviralce reakcij povratne transkripcije
—— Zaviralci povratne transkripcije vključujejo SDS, EDTA, glicerol, natrijev pirofosfat, spermidin, formamid, gvanidinsko sol itd. Kontrolno RNA zmešamo z vzorcem in primerjamo donos z reakcijo kontrolne RNA, da preverimo, ali obstaja inhibitor. Oborino RNA sperite s 70% (v/v) etanolom, da odstranite inhibitorje.
A-3 Nezadostno žarjenje temeljnih premazov, ki se uporabljajo za sintezo prve verige cDNA
—— Določite, da je temperatura žarjenja primerna za temeljne premaze, uporabljene v poskusu. Za naključne heksamere je priporočljivo vzdrževati temperaturo pri 25 ° C 10 minut, preden dosežete reakcijsko temperaturo. Za gensko specifične primerje (GSP) poskusite z drugim GSP ali preklopite na oligo (dT) ali naključni heksamer.
A-4 Majhna količina začetne RNA
—— Povečajte količino RNA. Za vzorce RNA, manjše od 50 ng, lahko v sintezi cDNA prve verige uporabimo 0,1 μg do 0,5 μg acetilnega BSA
A-5 Ciljno zaporedje ni izraženo v analiziranih tkivih.
—— Poskusi z drugimi tkivi.
A-6 PCR reakcija ne uspe
—— Za dvostopenjsko RT-PCR predloga cDNA v koraku PCR ne sme presegati 1/5 reakcijskega volumna.
A-1 Nespecifično žarjenje temeljnih premazov in šablon
—— 3'-konec premazov ne sme vsebovati 2-3 dG ali dC. V sintezi prve verige uporabite namensko naključne premaze ali oligo (dT). V prvih nekaj ciklih uporabite višjo temperaturo žarjenja in nato nižjo temperaturo žarjenja. Za PCR uporabite Tacra DNA polimerazo z vročim zagonom, da izboljšate specifičnost reakcije.
A-2 Slaba zasnova gensko specifičnih primerjev
—— Upoštevajte enaka načela za oblikovanje ojačevalnega premaza.
A-3 RNA, kontaminirana z genomsko DNA
——Zdravite RNA z DNazo razreda PCR I. Nastavite kontrolno reakcijo brez reverzne transkripcije, da odkrijete kontaminacijo DNA.
A-4 Oblikovanje temeljnega dimerja
—— Oblikujte primerje brez komplementarnih zaporedij na koncu 3 '.
A-5 Previsok Mg2+ koncentracija
—— Optimizirajte Mg2+ koncentracija za vsako kombinacijo šablone in temeljnega premaza
A-6 Okuženo s tujo DNK
—— Uporabljajte aerosolno odporne konice in encime UDG.
A-1 Vsebina izdelka prvega pramena je previsoka
—— Zmanjšajte količino produkta prve verige v običajni reakcijski stopnji PCR.
A-2 Previsoka količina primerja v reakciji PCR
—— Zmanjšajte vnos temeljnega premaza.
A-3 Preveč ciklov
—— Optimizirajte reakcijske pogoje PCR in zmanjšajte število ciklov PCR.
A-4 Prenizka temperatura žarjenja
——Povečajte temperaturo žarjenja, da preprečite nespecifično sprožitev in podaljšanje.
A-5 Nespecifična amplifikacija fragmentov oligonukleotidov, ki nastanejo z razgradnjo DNK DNaze-Izvlecite visokokakovostno RNA, da preprečite kontaminacijo DNA.
RT-PCR naj bi obrnil transkribirano RNA v cDNA in nato uporabil obratno prepisano cDNA kot predlogo za reakcijo PCR za amplifikacijo ciljnega fragmenta. Izberite bodisi naključne primerje, oligo dT in gensko specifične primerje glede na posebne pogoje poskusa. Vse zgornje primerje lahko uporabimo za mRNA s kratkimi evkariontskimi celicami brez strukture las.
Naključni primer: primeren za dolgo RNA s strukturo lasnic, pa tudi za vse vrste RNA, kot so rRNA, mRNA, tRNA itd. Uporabljajo se predvsem za RT-PCR reakcijo posamezne šablone.
Oligo dT: Primerno za RNA z oznako PolyA (prokariontska RNA, evkariontska oligo dT rRNA in tRNA nimajo repov PolyA). Ker je Oligo dT vezan na rep PolyA, mora biti kakovost vzorcev RNA visoka in tudi majhna količina razgradnje bo močno zmanjšala količino sinteze cDNA po celotni dolžini.
Gensko specifičen primer: Dopolnjuje zaporedje šablon, primeren za situacije, ko je ciljno zaporedje znano.
Obstajata dva načina:
1. Notranja referenčna metoda: V teoriji je cDNA fragmenti DNK različnih dolžin, zato je rezultat elektroforeze bris. Če je številčnost RNK majhna, se pri elektroforezi ne prikaže noben izdelek, vendar to ne pomeni, da s PCR ne bo ojačan noben izdelek. Na splošno lahko za odkrivanje cDNA uporabimo notranjo referenco. Če ima notranja referenca rezultate, je mogoče v bistvu zagotoviti kakovost cDNA (v nekaj primerih, če je fragment ciljnega gena predolg, lahko pride do izjem).
2. Če obstaja znani gen, ojačan s to šablono, ga lahko preverimo s primerji tega gena. Povečanje notranje reference ne pomeni nujno, da s cDNA ni težav. Ker ima notranja referenca veliko število cDNA, jo je enostavno povečati. Če se cDNA zaradi različnih razlogov delno razgradi, bodo z vidika verjetnosti močno vplivali rezultati PCR -jev ciljnih genov z nizko številčnostjo. Medtem ko je notranjih referenc še vedno veliko, na ojačanje verjetno ne bo vplivalo.
Delna razgradnja RNA. Odkrijte celovitost in očistite RNA
Vsebnost RNA pri različnih vrstah je lahko drugačna, vendar mora na splošno ekstrahirana celotna RNA vsebovati dva jasna pasu 28S in 18S v elektroforezi z gelom, svetlost prvega pasu pa mora biti dvakrat višja od svetlobe slednjega. Pas 5S označuje, da je RNA razgrajena, njena svetlost pa je sorazmerna s stopnjo razgradnje. Uspešno ojačanje notranje reference ne pomeni, da z RNA ni težav, ker je notranja referenca v velikem številu, se lahko RNA ojača, dokler razgradnja ni huda. OD260/OD280razmerje čiste RNA, merjeno s spektrofotometrom, mora biti med 1,9 in 2,1. Majhna količina nečistoč beljakovin v RNA bo zmanjšala razmerje. Dokler vrednost ni prenizka, to ne vpliva na RT. Za RT je najpomembnejša celovitost RNA.
Podaljšanje notranjega referenčnega gena lahko kaže le na to, da je RT uspelo, ni pa nujno povezano s kakovostjo verige cDNA. Ker so notranji referenčni fragmenti na splošno majhni in izraziti, je pri povratni transkripciji lažje uspeti. Vendar se velikost in izražanje ciljnega gena razlikujeta od gena do gena. Kakovosti cDNA ni mogoče oceniti le z notranjo referenco, zlasti za ciljne fragmente, daljše od 2 kb.
Nekateri vzorci imajo zapletene sekundarne strukture ali imajo bogato vsebnost GC ali so dragoceni z nizko številčnostjo. V teh primerih je treba izbrati ustrezno reverzno transkriptazo glede na velikost ciljnega fragmenta in vzorca. Za predloge RNA z visoko vsebnostjo GC in zapleteno sekundarno strukturo je težko odpreti sekundarno strukturo pri nizki temperaturi ali s skupno reverzno transkriptazo. Za te šablone lahko izberemo količinsko reverzno transkriptazo, saj je njena reverzna transkripcija očitno boljša kot pri reverzni transkriptazi serije M-MLV, ki lahko učinkovito obrne transkripcijo različnih predlog RNA in v največji možni meri prepiše RNA v prvo verigo cDNA. Pri uporabi splošnega kompleta reverzne transkriptaze lahko 20 μl sistem učinkovito obrne le 1 μg celotne RNA. Bodite pozorni na največjo RT zmogljivost kompleta. Če je predloga dodana v presežku, bo obratna transkripcija dala prednost RNK z veliko številčnostjo. Zato je bolje, da ne presežete največje zmogljivosti sistema.
A-1 Ugotovite, ali je RNA močno razgrajena in ali je RT uspešna
Na splošno je razlog za neuspeh notranjega referenčnega ojačanja pogosto huda degradacija RNA. Drug možen razlog je napaka povratne transkripcije. Notranja referenca se ne more uporabiti kot standard za presojo kakovosti enojne verige cDNA, lahko pa se uporabi kot standard za presojo, ali je obratna transkripcija uspešna, če ni težav s kakovostjo RNA. Najpomembnejša stvar v procesu povratne transkripcije je vzdrževanje konstantne temperature in konstantnega reakcijskega sistema, da se izboljša reakcijska učinkovitost.
A-2 Ugotovite, ali so primerji za pomnoževanje notranjih referenčnih genov zanesljivi in ali obstajajo težave z reagenti, uporabljenimi v PCR.
Za relativno količinsko opredelitev je treba RNA količinsko opredeliti pred reverzno transkripcijo, kar je potrebno tudi v številnih kompletih za povratno transkripcijo, na primer količinsko opredeliti vnos RNA kot 1 μg. Ker je reverzno prepisana cDNA mešana raztopina, vključno z RNA, oligo dT, encimom, dNTP in celo majhnim ostankom DNA, bo prišlo do odstopanja, zato je nemogoče natančno količinsko opredeliti cDNA. Zato je potrebna kvantifikacija RNA. Glede na to, da je učinkovitost povratne transkripcije pri različnih vzorcih enaka, mora biti količina pridobljene cDNA enaka, kvantitativna analiza pa lahko pokaže primerjavo ravni ekspresije različnih genov v isti količini celotne RNA. Pri izvajanju relativne fluorescenčne kvantitativne PCR po povratni transkripciji kvantitativna cDNA morda ne bo potrebna, ker lahko notranji referenčni gen deluje kot referenca.
V glavnem je povezan z geni in obratna transkripcija dolgih fragmentov za večino genov ni izvedljiva. Prvič, učinkovitost povratne transkripcije je veliko nižja kot pri PCR. Drugič, regija, bogata z GC, in sekundarna struktura mnogih genov omejujeta tako reverzno transkripcijo kot PCR. Končno je težko zagotoviti zvestobo in učinkovitost pomnoževanja PCR hkrati. V procesu povratne transkripcije nihče ne more zagotoviti, da bo dobil dolg fragment za gene z nizko kopijo, zlasti z uporabo oligo dT. Kar zadeva 5 'UTR z več GC, je to še težje. Zato je še vedno smiselna metoda obrniti transkript z naključnimi primerji, poiskati mesta naravnega razcepa v ciljnem fragmentu, ojačati po segmentih in nato opraviti restrikcijsko prebavo in ligacijo. Na splošno je težko neposredno ojačati fragmente, večje od 2 kb, vendar ni vedno nemogoče dobiti: 1. Najprej zagotovite celovitost RNA/mRNA in prednost je ekstrakcija TRIZOL -a. 2. Komplet M-MLV RT-PCR se lahko neposredno uporablja. Podaljšajte čas žarjenja in ustrezno povečajte število ciklov v procesu ojačanja. Druga možnost je, da uporabimo ugnezdeni PCR ali najprej izvedemo eno ali dve reakciji z ustrezno podaljšanim časom denaturacije in podaljšanja pred običajno PCR amplifikacijo, kar lahko pomaga podaljšati fragmente. Bodite pozorni na zvestobo polimeraze. 3. Dolg Taq je mogoče uporabiti v PCR za doseganje idealnih rezultatov. 4. Za uporabo pri izražanju beljakovin je treba uporabiti polimerazo visoke zvestobe.
TIANGEN ponuja dve vrsti reverzne transkriptaze: Quant/King RTase in TIANScript M-MLV. Glavna razlika med njimi je vnesena količina predlog. Quant je edinstvena reverzna transkriptaza, ki se razlikuje od običajno uporabljene M-MLV, pridobljene iz virusa Moloney mišje levkemije. Quant je nova visoko učinkovita reverzna transkriptaza, rekombinantno izražena z inženiringom Escherichia coli. Quant je primeren za amplifikacijo 50 ng-2 μg RNA z visoko reverzno transkripcijsko aktivnostjo in visokim donosom. V primerjavi z navadnimi MMLV ali AMV je Quantova največja značilnost ta, da ima zelo močno afiniteto s predlogami RNA in lahko obrne prepis kompleksnih predlog brez visokotemperaturne denaturacije. Pri predlogah z večjo vsebnostjo GC je obratna učinkovitost višja. Vendar ima ta reverzna transkriptaza aktivnost RNaze H, ki lahko vpliva na dolžino produkta cDNA (primerno za <4,5 kb šablone). Za običajno reverzno transkripcijo se priporoča reverzna transkriptaza TIANScript MMLV. Ta RTaza je modificiran encim z zelo šibko aktivnostjo RNaze H, ki je primeren za dolgo (> 5 kb) sintezo cDNA.
Enostopenjska reverzna transkripcija in amplifikacija PCR sta zaključeni v isti epruveti, ne da bi morali odpreti pokrov epruvete med sintezo in pomnožitvijo cDNA, kar je v pomoč pri zmanjševanju kontaminacije. Ker se vsi pridobljeni vzorci cDNA uporabljajo za pomnoževanje, je občutljivost večja, z najmanj 0,01 pg celotne RNA. Za uspešen enostopenjski RTPCR se za začetek sinteze cDNA običajno uporabljajo gensko specifični primerji. Dvostopenjska metoda, in sicer reverzna transkripcija in PCR amplifikacija, se izvede v dveh korakih. Najprej se izvede reverzna transkripcija iz predloge RNA za pridobitev cDNA, dobljena cDNA pa se podvrže eni ali več različnim reakcijam PCR. Dvostopenjska metoda lahko uporablja oligo (dT) ali naključne primerje za vodenje sinteze prve verige cDNA in lahko obratno prepiše vse informacije mRNA iz določenega vzorca.
Kategorije izdelkov
ZAKAJ SE IZBERI NAS
Naša tovarna že od svoje ustanovitve razvija izdelke prvega razreda z upoštevanjem načela
najprej kakovosti. Naši izdelki so v industriji pridobili odličen ugled in dragoceno zaupanje med novimi in starimi strankami.








