Komplet FastKing RT (z gDNase)
Lastnosti
■ Visoka učinkovitost: FastKing RT Encim je modificiran s hidrofobnim motivom, z RT učinkovitostjo več kot 95%.
■ Občutljivo: Predloge je mogoče natančno identificirati že pri 1 ng.
■ Odpornost: Sposobnost povratne transkripcije kompleksnih predlog, s popolno odpornostjo na nečistoče.
■ Prilagodljiv: Odstranitev genomske DNK in obratna transkripcija sta bili zaključeni ločeno. Temeljne premaze smo mešali ločeno v epruveti, fleksibilno za menjavo drugih temeljnih premazov.
Specifikacija
Vrsta: gensko spremenjena reverzna transkriptaza, gDNaza
Postopki: Dvostopenjski (odstranitev genomske DNA in RT)
Učinkovitost RT:> 95%
Predloga: 1 ng- 2 μg
Čas delovanja: ~ 21 min
Aplikacije: Obratno prepisano cDNA lahko uporabimo pri običajni PCR, PCR v realnem času, pri gradnji knjižnice cDNA.
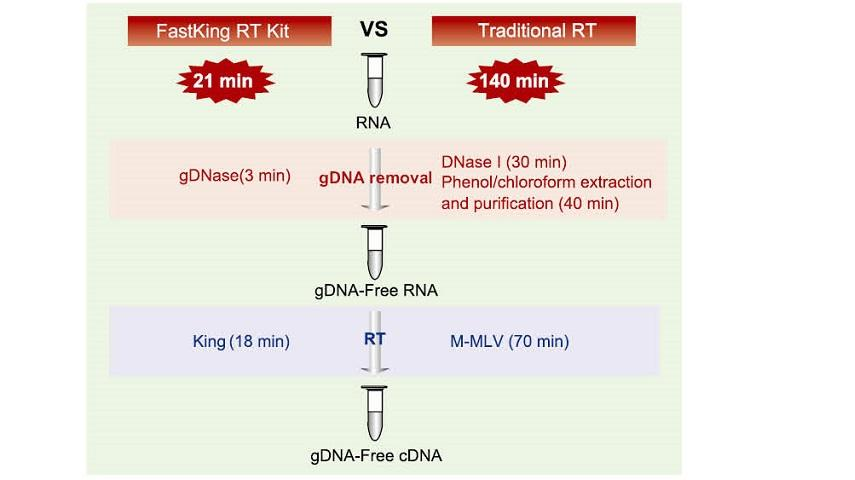
21 minutna reakcija v eni cevi
Za dokončanje odstranitve gDNA in učinkovitega procesa povratne transkripcije v isti epruveti traja le 21 minut, ne da bi zamenjali reakcijsko cev in neodvisen postopek zdravljenja z DNazo I. V primerjavi s tradicionalno metodo, ki zahteva 12-stopenjsko delovanje in 140-minutno reakcijo, močno poenostavi korake delovanja in prihrani veliko časa delovanja.
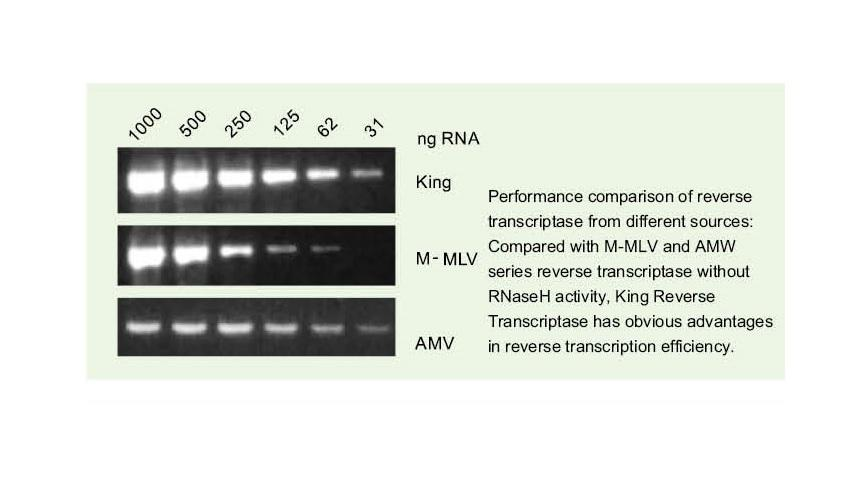
Izjemna kakovost King RTase
—— Izjemno visoka učinkovitost povratne transkripcije
—— Učinkovitost povratne transkripcije je več kot 95%
Splošna reverzna transkriptaza ima učinkovitost povratne transkripcije 40-60%, donos cDNA pa lahko povečamo z večjo količino nalaganja RNA. Kraljeva reverzna transkriptaza lahko zaradi svoje edinstvene visoke afinitete za predloge RNK doseže več kot 95 -odstotno učinkovitost povratne transkripcije. Zato je mogoče naslednje poskuse zadovoljiti brez potrebe po veliki količini vnosa RNA, kar prihrani RNA in omogoča visoko čistost in visok izkoristek cDNA.
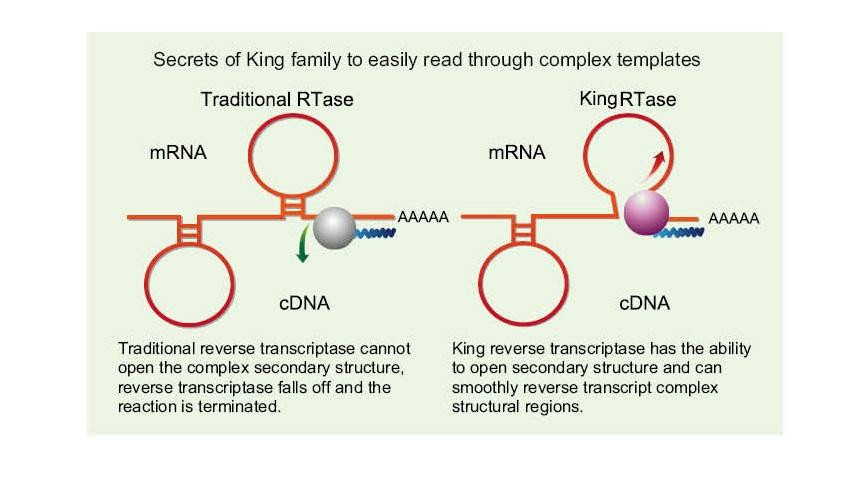
Preprosto preberite zapletene predloge
—— Enostavno preberite visoke GC in zapletene predloge
Enoverižna RNA ima zaradi vodikove vezi med verigami široko paleto kompleksnih regij sekundarne strukture. Običajna reverzna transkriptaza lahko pri naletu na kompleksno sekundarno strukturo povzroči prekinitev reverzne transkriptacije, zato ne more uspešno dokončati sinteze cDNA. Nova generacija King reverzne transkriptaze pa ima edinstveno strukturno domeno, ki lahko uniči vodikovo vez med verigami RNA, s čimer se odpre kompleksna sekundarna struktura RNA in zagotovi nemotena reverzna transkripcija.
Vse izdelke je mogoče prilagoditi za ODM/OEM. Za podrobnosti,kliknite prilagojeno storitev (ODM/OEM)
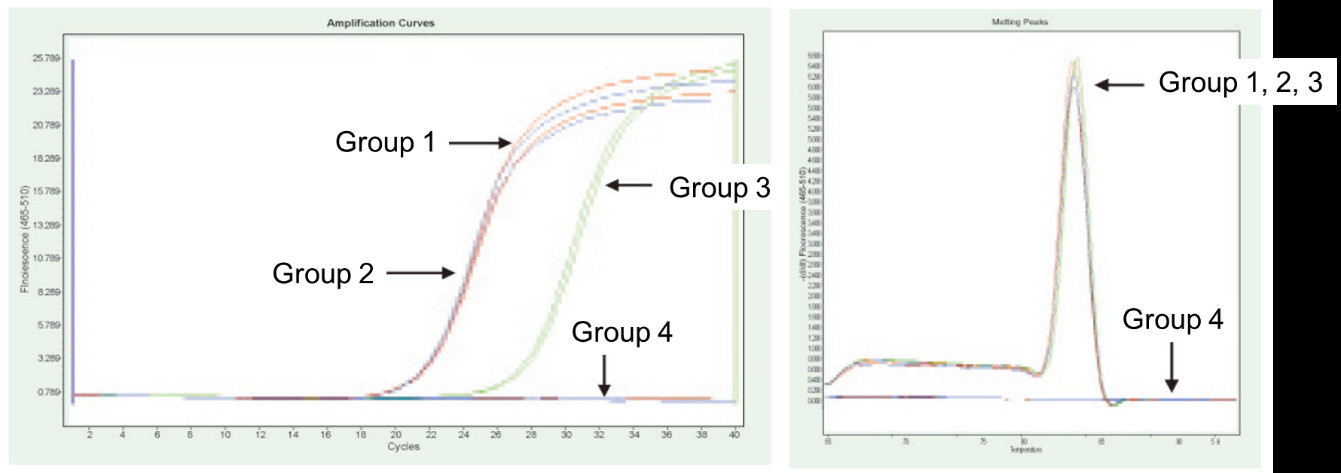 |
Skupina 1: Reverzna transkripcija brez zdravljenja z gDNazo; Skupina 2: Brez zdravljenja z gDNazo in brez povratne transkripcije; Skupina 3: Reverzna transkripcija po zdravljenju z gDNazo; Skupina 4: zdravljenje z gDNazo brez reverzne transkripcije. Metode: Fluorescenčna kvantitativna PCR detekcija gena TNF-alfa (primer, oblikovan na eksonu s cDNA ali genom kot predlogo) z uporabo 1 μg RNA celic Hela (z ostankom genoma) kot predlogo. Rezultati: Kot je prikazano na sliki, lahko skupina 2 odraža ostanek genoma v RNA, skupina 3 lahko natančno odraža resnično raven izražanja TNF-alfa, skupina 1 ima napake v končnih količinskih rezultatih zaradi ostankov genoma, skupina 4 pa kaže, da lahko FastKing RT Kit popolnoma odstrani preostalo genomsko DNA v RNA. |
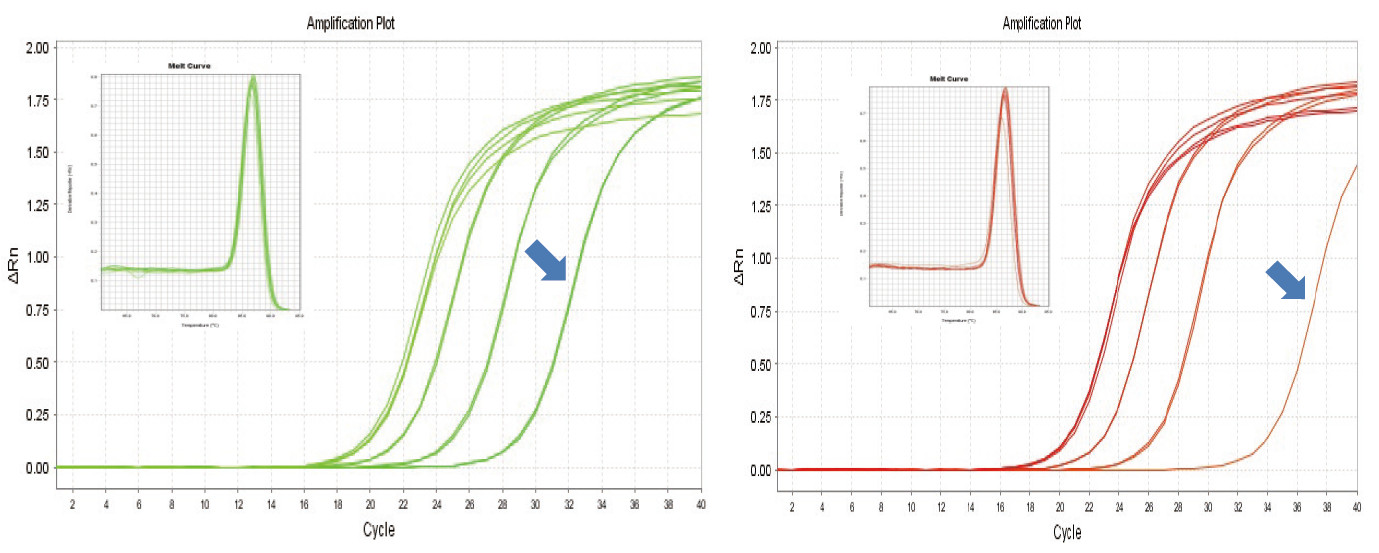 |
Slika 1. Reverzna transkripcija mišje RNA je bila izvedena z uporabo TIANGEN FastKing RT Kit (levo) in ustreznega produkta dobavitelja A (desno), nato je bil gen MM5 kvantitativno ojačan z uporabo TIANGEN SuperReal PreMix Plus (SYBR Green). Analizirali smo krivuljo ojačanja in krivuljo taljenja. Vnos RNA je bil 1000 ng, 100 ng, 10 ng in 1 ng. Rezultati kažejo, da ima komplet TIANGEN FastKing RT jasen gradient povratne transkripcije in nizko vrednost Ct ter ima očitne prednosti pri obratni transkripciji predloge z nizko številčnostjo (1 ng, modra puščica). |
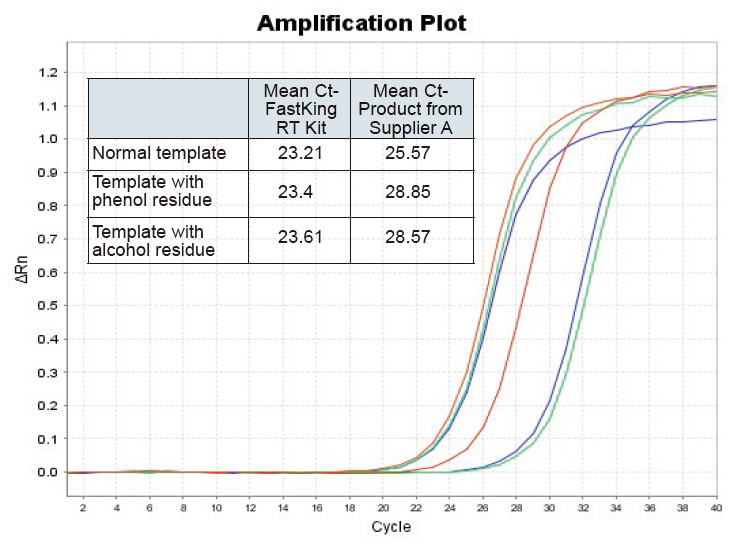 |
Slika 2. Obratna transkripcija normalne predloge RNA (rdeča), šablona z velikimi ostanki fenola (zelena) in šablona z ostanki alkohola (modra) pri podganah z uporabo kompleta TIANGEN FastKing RT in ustreznega izdelka dobavitelja A, količinsko opredelimo gene RNC z uporabo TIANGEN SuperReal Analizirali smo PreMix Plus (SYBR Green), krivulje ojačanja in vrednosti Ct. Rezultati kažejo, da ima komplet TIANGEN FastKing RT najnižjo količinsko vrednost Ct po obratni transkripciji in odlično odpornost na stres ter ima očitne prednosti za šablone z visokimi ostanki nečistoč |
A-1 RNA se razgradi
—— Očistite visoko kakovostno RNA brez kontaminacije. Material, iz katerega se ekstrahira RNA, mora biti čim bolj svež, da se prepreči razgradnja RNA. Pred reakcijo RT analizirajte celovitost RNA na denaturiranem gelu. Po ekstrakciji RNA jo je treba shraniti v 100% formamidu. Če se uporablja zaviralec RNaze, mora biti temperatura segrevanja <45 ° C, pH pa manjši od 8,0, sicer bo inhibitor sprostil vso vezano RNazo. Poleg tega je treba v raztopine, ki vsebujejo ≥ 0,8 mM DTT, dodati zaviralec RNaze.
A-2 RNA vsebuje zaviralce reakcij povratne transkripcije
—— Zaviralci povratne transkripcije vključujejo SDS, EDTA, glicerol, natrijev pirofosfat, spermidin, formamid, gvanidinsko sol itd. Kontrolno RNA zmešamo z vzorcem in primerjamo donos z reakcijo kontrolne RNA, da preverimo, ali obstaja inhibitor. Oborino RNA sperite s 70% (v/v) etanolom, da odstranite inhibitorje.
A-3 Nezadostno žarjenje temeljnih premazov, ki se uporabljajo za sintezo prve verige cDNA
—— Določite, da je temperatura žarjenja primerna za temeljne premaze, uporabljene v poskusu. Za naključne heksamere je priporočljivo vzdrževati temperaturo pri 25 ° C 10 minut, preden dosežete reakcijsko temperaturo. Za gensko specifične primerje (GSP) poskusite z drugim GSP ali preklopite na oligo (dT) ali naključni heksamer.
A-4 Majhna količina začetne RNA
—— Povečajte količino RNA. Za vzorce RNA, manjše od 50 ng, lahko v sintezi cDNA prve verige uporabimo 0,1 μg do 0,5 μg acetilnega BSA
A-5 Ciljno zaporedje ni izraženo v analiziranih tkivih.
—— Poskusi z drugimi tkivi.
A-6 PCR reakcija ne uspe
—— Za dvostopenjsko RT-PCR predloga cDNA v koraku PCR ne sme presegati 1/5 reakcijskega volumna.
A-1 Nespecifično žarjenje temeljnih premazov in šablon
—— 3'-konec premazov ne sme vsebovati 2-3 dG ali dC. V sintezi prve verige uporabite namensko naključne premaze ali oligo (dT). V prvih nekaj ciklih uporabite višjo temperaturo žarjenja in nato nižjo temperaturo žarjenja. Za PCR uporabite Tacra DNA polimerazo z vročim zagonom, da izboljšate specifičnost reakcije.
A-2 Slaba zasnova gensko specifičnih primerjev
—— Upoštevajte enaka načela za oblikovanje ojačevalnega premaza.
A-3 RNA, kontaminirana z genomsko DNA
——Zdravite RNA z DNazo razreda PCR I. Nastavite kontrolno reakcijo brez reverzne transkripcije, da odkrijete kontaminacijo DNA.
A-4 Oblikovanje temeljnega dimerja
—— Oblikujte primerje brez komplementarnih zaporedij na koncu 3 '.
A-5 Previsok Mg2+ koncentracija
—— Optimizirajte Mg2+ koncentracija za vsako kombinacijo šablone in temeljnega premaza
A-6 Okuženo s tujo DNK
—— Uporabljajte aerosolno odporne konice in encime UDG.
A-1 Vsebina izdelka prvega pramena je previsoka
—— Zmanjšajte količino produkta prve verige v običajni reakcijski stopnji PCR.
A-2 Previsoka količina primerja v reakciji PCR
—— Zmanjšajte vnos temeljnega premaza.
A-3 Preveč ciklov
—— Optimizirajte reakcijske pogoje PCR in zmanjšajte število ciklov PCR.
A-4 Prenizka temperatura žarjenja
——Povečajte temperaturo žarjenja, da preprečite nespecifično sprožitev in podaljšanje.
A-5 Nespecifična amplifikacija fragmentov oligonukleotidov, ki nastanejo z razgradnjo DNK DNaze-Izvlecite visokokakovostno RNA, da preprečite kontaminacijo DNA.
RT-PCR naj bi obrnil transkribirano RNA v cDNA in nato uporabil obratno prepisano cDNA kot predlogo za reakcijo PCR za amplifikacijo ciljnega fragmenta. Izberite bodisi naključne primerje, oligo dT in gensko specifične primerje glede na posebne pogoje poskusa. Vse zgornje primerje lahko uporabimo za mRNA s kratkimi evkariontskimi celicami brez strukture las.
Naključni primer: primeren za dolgo RNA s strukturo lasnic, pa tudi za vse vrste RNA, kot so rRNA, mRNA, tRNA itd. Uporabljajo se predvsem za RT-PCR reakcijo posamezne šablone.
Oligo dT: Primerno za RNA z oznako PolyA (prokariontska RNA, evkariontska oligo dT rRNA in tRNA nimajo repov PolyA). Ker je Oligo dT vezan na rep PolyA, mora biti kakovost vzorcev RNA visoka in tudi majhna količina razgradnje bo močno zmanjšala količino sinteze cDNA po celotni dolžini.
Gensko specifičen primer: Dopolnjuje zaporedje šablon, primeren za situacije, ko je ciljno zaporedje znano.
Obstajata dva načina:
1. Notranja referenčna metoda: V teoriji je cDNA fragmenti DNK različnih dolžin, zato je rezultat elektroforeze bris. Če je številčnost RNK majhna, se pri elektroforezi ne prikaže noben izdelek, vendar to ne pomeni, da s PCR ne bo ojačan noben izdelek. Na splošno lahko za odkrivanje cDNA uporabimo notranjo referenco. Če ima notranja referenca rezultate, je mogoče v bistvu zagotoviti kakovost cDNA (v nekaj primerih, če je fragment ciljnega gena predolg, lahko pride do izjem).
2. Če obstaja znani gen, ojačan s to šablono, ga lahko preverimo s primerji tega gena. Povečanje notranje reference ne pomeni nujno, da s cDNA ni težav. Ker ima notranja referenca veliko število cDNA, jo je enostavno povečati. Če se cDNA zaradi različnih razlogov delno razgradi, bodo z vidika verjetnosti močno vplivali rezultati PCR -jev ciljnih genov z nizko številčnostjo. Medtem ko je notranjih referenc še vedno veliko, na ojačanje verjetno ne bo vplivalo.
Delna razgradnja RNA. Odkrijte celovitost in očistite RNA
Vsebnost RNA pri različnih vrstah je lahko drugačna, vendar mora na splošno ekstrahirana celotna RNA vsebovati dva jasna pasu 28S in 18S v elektroforezi z gelom, svetlost prvega pasu pa mora biti dvakrat višja od svetlobe slednjega. Pas 5S označuje, da je RNA razgrajena, njena svetlost pa je sorazmerna s stopnjo razgradnje. Uspešno ojačanje notranje reference ne pomeni, da z RNA ni težav, ker je notranja referenca v velikem številu, se lahko RNA ojača, dokler razgradnja ni huda. OD260/OD280razmerje čiste RNA, merjeno s spektrofotometrom, mora biti med 1,9 in 2,1. Majhna količina nečistoč beljakovin v RNA bo zmanjšala razmerje. Dokler vrednost ni prenizka, to ne vpliva na RT. Za RT je najpomembnejša celovitost RNA.
Podaljšanje notranjega referenčnega gena lahko kaže le na to, da je RT uspelo, ni pa nujno povezano s kakovostjo verige cDNA. Ker so notranji referenčni fragmenti na splošno majhni in izraziti, je pri povratni transkripciji lažje uspeti. Vendar se velikost in izražanje ciljnega gena razlikujeta od gena do gena. Kakovosti cDNA ni mogoče oceniti le z notranjo referenco, zlasti za ciljne fragmente, daljše od 2 kb.
Nekateri vzorci imajo zapletene sekundarne strukture ali imajo bogato vsebnost GC ali so dragoceni z nizko številčnostjo. V teh primerih je treba izbrati ustrezno reverzno transkriptazo glede na velikost ciljnega fragmenta in vzorca. Za predloge RNA z visoko vsebnostjo GC in zapleteno sekundarno strukturo je težko odpreti sekundarno strukturo pri nizki temperaturi ali s skupno reverzno transkriptazo. Za te šablone lahko izberemo količinsko reverzno transkriptazo, saj je njena reverzna transkripcija očitno boljša kot pri reverzni transkriptazi serije M-MLV, ki lahko učinkovito obrne transkripcijo različnih predlog RNA in v največji možni meri prepiše RNA v prvo verigo cDNA. Pri uporabi splošnega kompleta reverzne transkriptaze lahko 20 μl sistem učinkovito obrne le 1 μg celotne RNA. Bodite pozorni na največjo RT zmogljivost kompleta. Če je predloga dodana v presežku, bo obratna transkripcija dala prednost RNK z veliko številčnostjo. Zato je bolje, da ne presežete največje zmogljivosti sistema.
A-1 Ugotovite, ali je RNA močno razgrajena in ali je RT uspešna
Na splošno je razlog za neuspeh notranjega referenčnega ojačanja pogosto huda degradacija RNA. Drug možen razlog je napaka povratne transkripcije. Notranja referenca se ne more uporabiti kot standard za presojo kakovosti enojne verige cDNA, lahko pa se uporabi kot standard za presojo, ali je obratna transkripcija uspešna, če ni težav s kakovostjo RNA. Najpomembnejša stvar v procesu povratne transkripcije je vzdrževanje konstantne temperature in konstantnega reakcijskega sistema, da se izboljša reakcijska učinkovitost.
A-2 Ugotovite, ali so primerji za pomnoževanje notranjih referenčnih genov zanesljivi in ali obstajajo težave z reagenti, uporabljenimi v PCR.
Za relativno količinsko opredelitev je treba RNA količinsko opredeliti pred reverzno transkripcijo, kar je potrebno tudi v številnih kompletih za povratno transkripcijo, na primer količinsko opredeliti vnos RNA kot 1 μg. Ker je reverzno prepisana cDNA mešana raztopina, vključno z RNA, oligo dT, encimom, dNTP in celo majhnim ostankom DNA, bo prišlo do odstopanja, zato je nemogoče natančno količinsko opredeliti cDNA. Zato je potrebna kvantifikacija RNA. Glede na to, da je učinkovitost povratne transkripcije pri različnih vzorcih enaka, mora biti količina pridobljene cDNA enaka, kvantitativna analiza pa lahko pokaže primerjavo ravni ekspresije različnih genov v isti količini celotne RNA. Pri izvajanju relativne fluorescenčne kvantitativne PCR po povratni transkripciji kvantitativna cDNA morda ne bo potrebna, ker lahko notranji referenčni gen deluje kot referenca.
V glavnem je povezan z geni in obratna transkripcija dolgih fragmentov za večino genov ni izvedljiva. Prvič, učinkovitost povratne transkripcije je veliko nižja kot pri PCR. Drugič, regija, bogata z GC, in sekundarna struktura mnogih genov omejujeta tako reverzno transkripcijo kot PCR. Končno je težko zagotoviti zvestobo in učinkovitost pomnoževanja PCR hkrati. V procesu povratne transkripcije nihče ne more zagotoviti, da bo dobil dolg fragment za gene z nizko kopijo, zlasti z uporabo oligo dT. Kar zadeva 5 'UTR z več GC, je to še težje. Zato je še vedno smiselna metoda obrniti transkript z naključnimi primerji, poiskati mesta naravnega razcepa v ciljnem fragmentu, ojačati po segmentih in nato opraviti restrikcijsko prebavo in ligacijo. Na splošno je težko neposredno ojačati fragmente, večje od 2 kb, vendar ni vedno nemogoče dobiti: 1. Najprej zagotovite celovitost RNA/mRNA in prednost je ekstrakcija TRIZOL -a. 2. Komplet M-MLV RT-PCR se lahko neposredno uporablja. Podaljšajte čas žarjenja in ustrezno povečajte število ciklov v procesu ojačanja. Druga možnost je, da uporabimo ugnezdeni PCR ali najprej izvedemo eno ali dve reakciji z ustrezno podaljšanim časom denaturacije in podaljšanja pred običajno PCR amplifikacijo, kar lahko pomaga podaljšati fragmente. Bodite pozorni na zvestobo polimeraze. 3. Dolg Taq je mogoče uporabiti v PCR za doseganje idealnih rezultatov. 4. Za uporabo pri izražanju beljakovin je treba uporabiti polimerazo visoke zvestobe.
TIANGEN ponuja dve vrsti reverzne transkriptaze: Quant/King RTase in TIANScript M-MLV. Glavna razlika med njimi je vnesena količina predlog. Quant je edinstvena reverzna transkriptaza, ki se razlikuje od običajno uporabljene M-MLV, pridobljene iz virusa Moloney mišje levkemije. Quant je nova visoko učinkovita reverzna transkriptaza, rekombinantno izražena z inženiringom Escherichia coli. Quant je primeren za amplifikacijo 50 ng-2 μg RNA z visoko reverzno transkripcijsko aktivnostjo in visokim donosom. V primerjavi z navadnimi MMLV ali AMV je Quantova največja značilnost ta, da ima zelo močno afiniteto s predlogami RNA in lahko obrne prepis kompleksnih predlog brez visokotemperaturne denaturacije. Pri predlogah z večjo vsebnostjo GC je obratna učinkovitost višja. Vendar ima ta reverzna transkriptaza aktivnost RNaze H, ki lahko vpliva na dolžino produkta cDNA (primerno za <4,5 kb šablone). Za običajno reverzno transkripcijo se priporoča reverzna transkriptaza TIANScript MMLV. Ta RTaza je modificiran encim z zelo šibko aktivnostjo RNaze H, ki je primeren za dolgo (> 5 kb) sintezo cDNA.
Enostopenjska reverzna transkripcija in amplifikacija PCR sta zaključeni v isti epruveti, ne da bi morali odpreti pokrov epruvete med sintezo in pomnožitvijo cDNA, kar je v pomoč pri zmanjševanju kontaminacije. Ker se vsi pridobljeni vzorci cDNA uporabljajo za pomnoževanje, je občutljivost večja, z najmanj 0,01 pg celotne RNA. Za uspešen enostopenjski RTPCR se za začetek sinteze cDNA običajno uporabljajo gensko specifični primerji. Dvostopenjska metoda, in sicer reverzna transkripcija in PCR amplifikacija, se izvede v dveh korakih. Najprej se izvede reverzna transkripcija iz predloge RNA za pridobitev cDNA, dobljena cDNA pa se podvrže eni ali več različnim reakcijam PCR. Dvostopenjska metoda lahko uporablja oligo (dT) ali naključne primerje za vodenje sinteze prve verige cDNA in lahko obratno prepiše vse informacije mRNA iz določenega vzorca.
Kategorije izdelkov
ZAKAJ SE IZBERI NAS
Naša tovarna že od svoje ustanovitve razvija izdelke prvega razreda z upoštevanjem načela
najprej kakovosti. Naši izdelki so v industriji pridobili odličen ugled in dragoceno zaupanje med novimi in starimi strankami.










